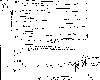 Concentraciones atmosféricas de desde a) 1977-1988 y b) los últimos 200 anos. Houghton, J.T., G.J. Jenkins, J.J. Ephraums, eds, 1990: 1990 Intergovernment Panel on Climate Change, Cambridge University Press.
Concentraciones atmosféricas de desde a) 1977-1988 y b) los últimos 200 anos. Houghton, J.T., G.J. Jenkins, J.J. Ephraums, eds, 1990: 1990 Intergovernment Panel on Climate Change, Cambridge University Press.
| 1-6: In English | 1-6: Em Português |
Eugene S. Takle
© 1997
En esta lectura examinamos otros gases traza atmosféricos para los cuales se han observado incrementos en sus concentraciones. El oxido nitroso,, es un gas incoloro, inodoro,no reactivo y muy estable en la atmósfera (vida media de 110-168 anos). No es posible confundirlo con, NO, u otros óxidos de nitrógeno. Las concentraciones de oxido nitroso se han estado incrementando con el tiempo, como se observa en la gráfica que registra mediciones en varias localidades desde 1977. Es importante notar que las unidades para las mediciones son partes por billón por volumen (ppbv). Las concentraciones de oxido nitroso son por lo tanto un quinto de la concentración de metano y cerca de cien veces menor que del dióxido de carbono.
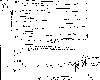 Concentraciones atmosféricas de desde a) 1977-1988 y b) los últimos 200 anos. Houghton, J.T., G.J. Jenkins, J.J. Ephraums, eds, 1990: 1990 Intergovernment Panel on Climate Change, Cambridge University Press.
Concentraciones atmosféricas de desde a) 1977-1988 y b) los últimos 200 anos. Houghton, J.T., G.J. Jenkins, J.J. Ephraums, eds, 1990: 1990 Intergovernment Panel on Climate Change, Cambridge University Press.
Datos sobre una escala mayor de tiempo derivados de núcleos de hielo muestran que por mas de 2,000 anos las concentraciones han estado constantes en cerca de 280 ppbv desde los inicios de la Revolución Industrial, a partir de la cual justamente se ha iniciado un dramático incremento el cual continua hoy en 0.2 a 0.3% por ano.
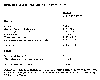 Fuentes y depósitos estimados de oxido nitroso. Adaptado de la tabla 1.4, p 26, de Houghton, J.T., G.J. Jenkins, J.J. Ephraums, eds, 1990: 1990 Intergovernment Panel on Climate Change, Cambridge University Press.
Fuentes y depósitos estimados de oxido nitroso. Adaptado de la tabla 1.4, p 26, de Houghton, J.T., G.J. Jenkins, J.J. Ephraums, eds, 1990: 1990 Intergovernment Panel on Climate Change, Cambridge University Press.
Nosotros conocemos las fuentes de oxido nitroso. Las fuentes naturales incluyen océanos, suelos tropicales, bosques húmedos, savanas secas y bosques extra tropicales. Las emisiones totales son de cerca de 4-10 x 1012 gramos, o 4-10 Tg. Las fuentes antropogenicas incluyen suelos cultivados (incluyendo el uso de fertilizantes nitrogenados), biomasa quemandose,otros procesos de combustión, y procesos de producción de ácidos. El mayor proceso conocido para la destrucción del oxido nitroso es la fotolisis extratosferica (obtenida por energía solar, principalmente radiación ultravioleta). De las estimaciones podemos observar que, a pesar de la gran incertidumbre, la carga de oxido nitroso por contribución del humano a la atmósfera es comparable con las fuentes naturales y es casi la responsable por el incremento de las 3-4.5 Tg por ano del oxido nitroso en la atmósfera. Debido a su larga vida media (estabilidad) en la troposfera, los procesos naturales son incapaces de detener este incremento.
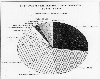 Consumo de fertilizantes nitrogenados. EPA.
Consumo de fertilizantes nitrogenados. EPA.
El uso de fertilizantes nitrogenados en agricultura resultan ser significativas fuentes antropogenicas de oxido nitroso. Como lo muestra la figura, la China es un gran usuario, seguida (de acuerdo a estos datos) por la Unión Societica, Estados Unidos e India. En conversaciones con los voceros oficiales, en mi reciente viaje a Rusia, aprendí que las dificultades económicas actuales en ese país, han reducido significativamente su disponibilidad de fertilizantes y pesticidas, así, la figura no refleja las condiciones actuales.
En la reciente unidad de conocimiento podemos regresar a la física y química de la estratosfera y revisar los problemas ocasionados por el dióxido nitroso en la estratosfera.
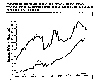 Emisiones anuales de y desde1900-1980. EPA.
Emisiones anuales de y desde1900-1980. EPA.
Otros óxidos de nitrógeno también se han adicionado a la atmósfera en cantidades crecientes. En el siguiente gráfico se muestran las emisiones antropogenicas de compuestos nitrogenados reportados por la EPA en los Estados Unidos.
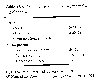 Recursos estimados de Oxidos de Nitrógeno. Adaptado de IPCC, 1992. EPA.
Recursos estimados de Oxidos de Nitrógeno. Adaptado de IPCC, 1992. EPA.
El NO yson gases que en conjunto con el y el aerosol comprenden lo que llamamos. Las emisiones anuales de por los últimos 80 anos en los Estados Unidos se han incrementado dramáticamente, desde menos de 1 hasta cerca de 22 Tg (teragramos, o millones de toneladas métricas). Como una base global de recursos naturales de se incluyen los suelos (5-20 Tg anualmente) y relámpagos (2-20 Tg anualmente) dando una cantidad total anual de 8 a 41 Tg. Los recursos antropogenicos contribuyen anualmente con 27 a 38 Tg por combustión completa de fósiles, biomasa quemándose, y actividad aérea troposfera. Estos valores indican que los humanos estamos emitiendo óxidos de nitrógeno a la atmósfera en una cantidad anual total que es comparable en magnitud, a los recursos naturales.
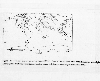
 Ciclo del Nitrógeno. J. D. Butler, Air Pollution Chemistry, 1979
Ciclo del Nitrógeno. J. D. Butler, Air Pollution Chemistry, 1979
Para entender como el Nitrógeno se desplaza a través de la tierra/ océanos/medio ambiente atmosférico, debemos observar el ciclo del nitrógeno, el cual nos da la fuente y vía del nitrógeno y los flujos entre estos reservorios, como se muestra en la figura de abajo. Estos valores están sujetos a grandes errores y son solo para ilustraciones. El principal concepto a seguir de esta figura es que hay dos componentes en el ciclo del nitrógeno: el lado derecho de la mano representa las interacciones troposfericas e intercambios con la superficie por, y el lado izquierdo de la mano describe el oxido de nitrógeno, que es considerado separadamente. Los componentes de la mano derecha,todos son parte del ciclo rápido: Son totalmente reactivos, y en un par de semanas estarán en los ciclos en y fuera de la capa baja de la atmósfera. Pero, por supuesto, como continuamos aumentándolo todo el tiempo tendremos esta provisión en la atmósfera. Sinembargo, si fuéramos capaces de eliminar las fuentes naturales y antropogenicas, las concentraciones atmosféricas podrían decrecer rápidamente a cero en un par de semanas.
 Procesos Biogeoquimicos. Programa para Investigación d e Cambio Global en U. S.
Procesos Biogeoquimicos. Programa para Investigación d e Cambio Global en U. S.
También mostramos las diversas rutas y transformaciones a través de estos diferentes ciclos. Por ahora, si algo de nitrógeno ingresa a la atmósfera, como NO es transformado a o después puede regresar al suelo como NO2 o convertido en aerosol, y juntos después ser removidos por lluvia o depositado como partícula seca. El gas se puede convertir directamente en partículas o retenerse en gotas de lluvia y eventualmente regresar al suelo o al océano. Una descripción similar se aplica a las diversas transformaciones del amoniaco ().
Por otro lado, el oxido nitroso sigue una ruta diferente: No experimenta transformaciones químicas, remoción por lluvia o deposición seca en la atmósfera. Una vez emitidas las moléculas de oxido nitroso viajan a través de la baja , posiblemente por décadas, hasta tener la oportunidad de visitar la baja atmósfera donde son transformadas por luz ultravioleta en O y NO. El Ns puede formar, pero el NO queda disponible para participar en el agotamiento del ozono. Lo puntual en el diagrama es que, de los compuestos nitrogenados emitidos a la superficie por procesos naturales u antropogenicos, solo el oxido nitroso se mantiene para migrar a la estratosfera y crear problemas a ese nivel. Los óxidos del nitrógeno causan problemas de lluvia ácida en la atmósfera baja, como podemos observar después, pero ellos no contribuyen significativamente al calentamiento global u agotamiento del ozono.
Existen varias interrogantes sin respuestas relacionadas con los desplazamientos del nitrógeno a través de la biosfera, atmósfera y el suelo. Estas interrogantes han sido consideradas en investigaciones intensivas de bioquímica en la atmósfera baja.
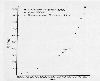 Emisiones globales anuales estimadas por emisiones
de Azufre desde 1860-1980. Eventos desconocidos.
Emisiones globales anuales estimadas por emisiones
de Azufre desde 1860-1980. Eventos desconocidos.
Las emisiones de azufre a la atmósfera por fuentes antropogenicas en US también se han incrementado, como se muestra en el diagrama de abajo. En U. S. las emisiones de azufre por ano desde 1860 a 1980 se incrementaron desde cerca de 10 Tg hasta un nivel cerca a32 Tg en 1970. Las regulaciones medioambientales han logrado reducir substancialmente estas emisiones en los anos recientes, en US y en varios piases en vías de desarrollo que han permitido instalar equipos para mitigar las emisiones de azufre. Los países en vías de desarrollo que han experimentado rápido crecimiento o utilizan mucho azufre de carbón y tienen equipos con baja tecnología para la combustión, han experimentado crecimiento en las emisiones.
 Fuentes estimadas de gases de azufre de corta vida.
Adaptado de IPCC, 1992.
Fuentes estimadas de gases de azufre de corta vida.
Adaptado de IPCC, 1992.
La principal fuente global de azufre antropogenico proviene de la combustión del carbón con mucho azufre,el cual contribuye con 70-80 Tg de azufre por ano, mayormente en forma de dióxido de azufre (). La biomasa quemada contribuye con 0 .8 a 2.5 Tg del total global. Las fuentes principales incluyen la producción oceánica de dimetil sulfito, y la producción de DMS , ácido sulfidrico (), por suelos y plantaciones. Las actividades volcánicas que por supuesto son fuentes episódicas , pueden contribuir de 7 a 10 Tg anualmente. Este cuadro muestra claramente que ahora la emisión antropogenica lideriza a la fuente natural de azufre en la atmósfera.
Los compuestos de azufre como , son especies de vida corta en la atmósfera, que están sujetos a transformaciones químicas, lavados, deposición en seco, e inducción a problemas de lluvia acida.Reconocemos al dióxido de azufre como un contaminante porque reacciona con el agua ( H2O ) para formar ácido sulfúrico. Si fuéramos capaces de eliminar las plantas poderosas y también otras fuentes antropogenicas de azufre, podríamos básicamente eliminar el azufre de la atmósfera en un par de semanas.
 El ciclo del azufre en la biosfera. J. D. Butler, Air Pollution
Chemistry, 1979 .
El ciclo del azufre en la biosfera. J. D. Butler, Air Pollution
Chemistry, 1979 .
El ciclo del azufre se puede dividir, en el ciclo en el agua y el ciclo en la tierra. En comparación con el ciclo del nitrógeno, inmediatamente notamos que el ciclo del azufre no tiene conexión con la atmósfera, por eso no hay especies de azufre con vida larga. El azufre es un problema, por supuesto en la atmósfera, como un contaminante aéreo, por el cual podemos volver en la unidad de aprendizaje posterior.
 Concentraciones simuladas de azufre a 900hPa. IPCC, 1990
Concentraciones simuladas de azufre a 900hPa. IPCC, 1990
La próxima figura muestra una simulación de concentración de sulfato en la atmósfera baja ( a un nivel de 900 hectopascales, que corresponde a cerca de un kilometro arriba de la superficie terrestre) . Los valores gratificados son relaciones sin dimensiones de la concentración antropogenica por el azufre natural dividido por la concentración basada en emisiones anuales. Las áreas industriales y altamente pobladas en la parte este de U.S. y el este de Europa tienen elevadas concentraciones. Las concentraciones sobre Asia se incrementan, particularmente en el área industrial del sudeste de China. Por supuesto,como la industrialización en China se incrementa rápidamente, probablemente esto es un problema en aumento en ese país.
Un resultado reciente, y otro que ha puesto a los ambientalistas en un dilema desconcertante, es que siempre es un efecto secundario del dióxido de azufre en la atmósfera terrestre. Aunque no es un gas invernadero, hace contribuciones al bance de la radiación en la tierra. Ante la presencia de nubes, el SO2atmosferico es disuelto en las gotas de agua y forma ácido sulfúrico acuoso,. Estas nubes observadas desde el espacio se aprecian mas brillantes que las nubes naturales, lo que hace pensar que ellas están reflejando mayor radiación solar que las naturales. Este proceso es llamado brillantes nubosa y reduce la cantidad de energía solar que penetra a la tierra/ atmósfera/ sistema oceánico, contribuyendo así al enfriamiento del planeta. El resultado neto de la combustión completa de fósiles de azufre fera(principalmente carbón) es la inducida por emisión de al calentamiento global y la emitida por al e nfriamiento global. Los ambientalistas han luchado por anos para reducir la emisión de pero el resultado de estos esfuerzos parecen ser que el calentamiento global será exacerbado.
Otra posible relación del azufre con el cambio global tiene que ver con la función del dimetil sulfito (DMS) en la formación de nubes sobre áreas oceánicas. El DMS es producido de forma natural en áreas oceánicas por actividad biológica. Los estudios han revelado que el DMS puede promover la producción de núcleos por (de) condensación de nubes, lo cual favorece a las partículas para el crecimiento de nubes con gotas. Por lo tanto la abundancia de plantas marinas puede producir suficientes cantidades de DMS y aumentar la formación de nubes locales y posibilita el incremento de la precipitación. Esto se convierte en el eslabón directo entre la biosfera y la meteorología local. También abre la posibilidad para que pueda haber un eslabón entre los cambios en el ozono estratosferico y la meteorología local,por lo tanto, al incrementarse los niveles de radiación ultravioleta sobre el océano, se puede suspender la actividad biológica en ellos, lo que en su momento permitiría reducir las emisiones de DMS, y a su vez reducir la nubosidad y precipitación en áreas oceánicas. No conocemos suficiente aceca de la magnitud de ese efecto, para poder evaluar su importancia en relación con otros procesos de cambio global.
Otras preguntas relacionadas al ciclo del azufre, sus componentes en el flujo y reservas indican que debemos hacer muchas investigaciones con este gas traza.preguntas con .
El fósforo es otro elemento que es usado por las plantas en los océanos y en la tierra, y esa disponibilidad de fósforo en los suelos y los océanos es un regulador de la actividad biológica. Hay muchas preguntas sin responder en relación alciclo del fósforo. El mecanismo que controla la disponibilidad de fósforo en la tierra y como responde a procesos como la deposición de ácidos, fuego,y deforestación, no son bien conocidos. Por el uso de pesticidas en la tierra, podemos estar produciendo desbalances en la disponibilidad de otros nutrientes que las plantas necesitan. Cual es el flujo de fósforo marino en los océanos? Como ha cambiado en el pasado y como cambia hoy? Cuales son las consecuencias con estos cambios ? / Muchos temas se mantienen sin respuesta.
Por estas preguntas y por nuestra consideraciones con otros ciclos químicos, no es posible considerar por separado ninguno de los elementos como el carbon,,nitrogeno, azufre o fósforo. Las plantas contienen principalmente carbono, pero necesitan nitrógeno, azufre y fósforo. Así, un completo entendimiento del ciclo del carbono requiere un entendimiento de los grandes sistemas conocidos con el termino de ciclos biogeoquimicos. Otros gases traza de menor importancia global son también agrupados en esta categoría general, porque pueden participar en una o mas de las diversas rutas seguidas por la mayoría de los químicos en sus ciclos naturales.
El ozono troposferico es un constituyente químico traza en los ciclos biogeoquimicos naturales, pero representa un problema medioambiental debido a la gran fuente antropogenica en las grandes ciudades. En unidades de aprendizaje posteriores, podemos discutir el problema de disminución de las cantidades de ozono en la estratosfera,pero por ahora nos concentraremos en el exceso de ozono en las capas bajas de la atmósfera. El ozono es un químico muy reactivo que interactiva con las plantas y tejidos en animales vivos de forma perjudicial.Ello puede reducir la función pulmonar en humanos y detiene el crecimiento de las plantas hasta reducir los campos agrícolas y las cosechas en horticultivos.
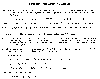 Formación/destrucción de ozono troposferico. Mckee, David J. 1994: Tropospheric Ozone: Human Health and Agricultural Impacts. Lewis Publications, Boca Raton. 333 pp.
Formación/destrucción de ozono troposferico. Mckee, David J. 1994: Tropospheric Ozone: Human Health and Agricultural Impacts. Lewis Publications, Boca Raton. 333 pp.
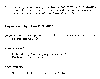 Impactos por elevados niveles de ozono. Mckee, David J. 1994: Tropospheric Ozone: Human Health and Agricultural Impacts. Lewis Publications, Boca Raton. 333 pp.
Impactos por elevados niveles de ozono. Mckee, David J. 1994: Tropospheric Ozone: Human Health and Agricultural Impacts. Lewis Publications, Boca Raton. 333 pp.
El ozono es formado en la troposfera por varias reacciones químicas que involucran una combinación de los óxidos del nitrógeno, compuestos orgánicos volátiles reactivos (VOC) producidos por un combinado de hidrocarburos no procesados por los automóviles y el oxigeno diatomico en presencia de luz solar. Elevadas temperaturas atmosféricas y/o radiación intensa a elevadas latitudes son esenciales para la formación de ozono.
Para la creación de ozono, las reacciones típicas incluyen al dióxido de nitrógeno, con acción de la luz solar en la banda de longitud de onda de 295 y 430 micrones, dando NO mas un oxigeno . El oxigeno libre se combina con el oxigeno diatomico, en presencia de otra molécula (para producir un valance momentáneo) para producir ozono. Una reacción rápida para descomponer el ozono, consiste de NO interactuando con ozono para producir y. Con la constante producción de ozono y su desintegración por estas dos reacciones, cuando la condición de equilibrio se establece el constituyente intermediario llamado ozono, persiste a una concentración determinada, por la relación en la abundancia de y NO. Por la oxidación del fotoquimicamente reactivo VOCs se forman especies químicas con elevada reactividad conocidas como radicales libres, capaces de convertir NO y sin la descomposición del. Como resultado, estos compuestos orgánicos volátiles, principalmente producidos por los automoviles,pueden interferir con el proceso de desintegración del ozono natural y permitir que se produzcan elevadas concentraciones de ozono.
Si alguno de los cuatro integrantes (, VOC,, y luz solar) no esta, las concentraciones de ozono disminuyen. En las grandes ciudades, a la hora de mayor trafico y en días claros y tibios se proveen las suficientes cantidades de todos los integrantes, pero la eliminación de alguno reduce significativamente los niveles de ozono.
Cualquier cosa susceptible de oxidación es un blanco potencial, para los efectos adversos de elevar las concentraciones de ozono. El pulmón del humano, por lo tanto, particularmente en personas con problemas respiratorios, pueden experimentar disminución en la funcionabilidad o reducir su capacidad.Las tablas adjuntas presentan ejemplos de perdidas de rendimiento para una variedad de cosechas en agricultura y horticultura, producidas por elevados niveles de ozono.
 Perdida de rendimiento en plantas producto del ozono troposferico. Adaptado de McKee, D. J., Tropospheric Ozone: Lewis Publications, 1994.
Perdida de rendimiento en plantas producto del ozono troposferico. Adaptado de McKee, D. J., Tropospheric Ozone: Lewis Publications, 1994.
Los frijoles, por ejemplo, bajo una concentración de ozono de .081 partes por millón produce una perdida de rendimiento de cerca de 30% . El umbral estándar de EPA para el ozono es .12 ppm, así a niveles bajos del estándar de EPA , los frijoles pueden sufrir perdida de rendimiento.
 Resumen para las concentraciones predichas de ozono que causan 10 - 30% de perdida de rendimiento y resumen para las perdidas de rendimiento predichas para ocurrencia a 7-h del promedio estacional para concentraciones de ozono de 0.04 y 0.06 ppm. Adaptado de McKee, David J., 1994: Ozono troposferico.
Resumen para las concentraciones predichas de ozono que causan 10 - 30% de perdida de rendimiento y resumen para las perdidas de rendimiento predichas para ocurrencia a 7-h del promedio estacional para concentraciones de ozono de 0.04 y 0.06 ppm. Adaptado de McKee, David J., 1994: Ozono troposferico.
Otras cosechas de granos, como la de trigo por ejemplo, parecen ser menos vulnerables que la de frijoles. un rápido vistazo a las listas de los vegetales siempre muestran que las concentraciones de ozono bajo el estándar de EPA pueden producir reducciones significativas en el rendimiento de todas las variedades.
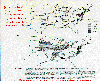 Perdida relativa de rendimiento para frijoles en 1987. McKee, David J., 1994: Ozono troposferico. Figura 7, p 193. Reproducido con autorización de CRC Press, Inc.
Perdida relativa de rendimiento para frijoles en 1987. McKee, David J., 1994: Ozono troposferico. Figura 7, p 193. Reproducido con autorización de CRC Press, Inc.
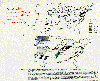 Perdida relativa de rendimiento para trigo en 1987. McKee, David J., 1994: Ozono troposferico. Figura 7, p 193. Reproducido con autorización de CRC Press, Inc.
Perdida relativa de rendimiento para trigo en 1987. McKee, David J., 1994: Ozono troposferico. Figura 7, p 193. Reproducido con autorización de CRC Press, Inc.